免疫荧光显微成像详解(上)——免疫荧光原理、步骤
免疫荧光技术是在免疫学、生物化学和显微镜技术的基础上建立起来的一项技术,它是将不影响抗原抗体活性的荧光色素标记在抗体(或抗原)上,与其相应的抗原(或抗体)结合后,在荧光显微镜下呈现一种特异性荧光反应。利用荧光显微镜可以看见荧光所在的细胞或组织,从而确定抗原或抗体的性质和定位,以及利用定量技术(比如流式细胞仪)测定含量。
直接法将标记的特异性荧光抗体,直接加在抗原标本上,经一定的温度和时间的染色,用水洗去未参加反应的多余荧光抗体,室温下干燥后封片、镜检。
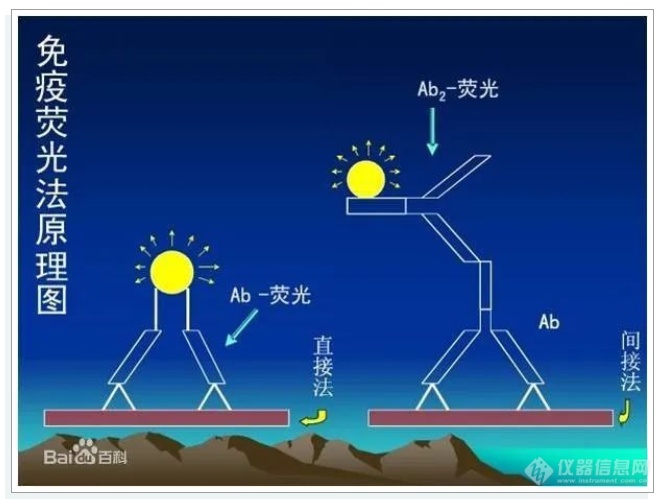
间接法如检查未知抗原,先用已知未标记的特异抗体(第一抗体)与抗原标本进行反应,用水洗去未反应的抗体,再用标记的抗抗体(第二抗体)与抗原标本反应,使之形成抗体—抗原—抗体复合物,再用水洗去未反应的标记抗体,干燥、封片后镜检。如果检查未知抗体,则表明抗原标本是已知的,待检血清为第一抗体,其它步骤的抗原检查相同。
标记的抗抗体是抗球蛋白抗体,同于血清球蛋白有种的特异性,如免疫抗鸡血清球蛋白只对鸡的球蛋白发生反应,因此,制备标记抗体适用于任何抗原的诊断。
免疫荧光实验的主要步骤包括 样片制备、固定及通透(或称为透化)、封闭、抗体孵育、封片及荧光检测等。
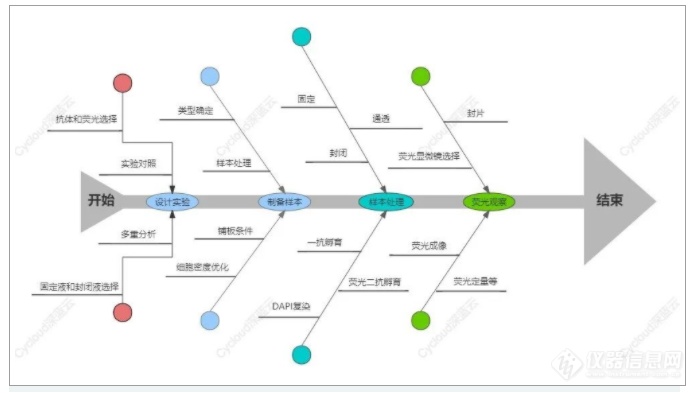
对于单层生长细胞,在传代培养时,将细胞接种到预先放置有处理过(70%乙醇中浸泡)的盖玻片的培养皿中,待细胞接近长成单层后取出盖玻片即可,操作的流程要小心,防止细胞脱片。
对于悬浮生长细胞,有两种方式,一种是取对数生长细胞,制备细胞片或直接制备细胞涂片,把细胞片浸入封闭液中固定,封闭后滴加一抗和二抗孵育;另一种是先在悬浮液中做固定和染色,离心洗脱后,用移液管移至盒式玻片进行后续抗体孵育。
对于冰冻切片制备,建议用新鲜组织,否则组织细胞内部结构破坏,易使抗原弥散。组织一定要冷冻适度,切片时选用干净锋利的刀片,防止裂片和脱片。
固定时间则取决于固定组织切片的大小和类型,对大多数组织,18-24h即可,而细胞的固定时间较短。
针对胞内抗原,使用0.5% Triton X-100或丙酮等通透剂进行通透,这一步的目的是使抗体进入胞内。
为防止内源性非特异性蛋白抗原的结合,需要在一抗孵育前先用封闭液(一般来说包括与二抗同一来源的血清、BSA或者羊血清)封闭,减弱背景着色。封闭开始后,要注意样品的保湿,避免样品干燥,否则极易产生较高的背景。
一抗孵育温度大体上分为:4℃、室温、37℃,其中4℃效果更加好;孵育时间与温度、抗体浓度有关,一般37℃孵育1-2h,4℃过夜(从冰箱拿出后37℃复温45min)。具体条件还要根据样品、稀释液等条件进行摸索尝试。
荧光二抗孵育一般在室温或37℃孵育30min-1h,该过程必须在避光环境下进行,防止荧光淬灭。荧光素标记的二抗随着保存时间的延长,可能会出现大量的游离荧光素残留,必须要格外注意配制时采用小包装并进行适当的离心。
一般采用DAPI进行复染,目的是形成细胞轮廓,从而更好地对目标蛋白进行定位。
为了长期保存,我们应该对样本做封片,用吸水纸吸干爬片上的液体,一般用缓冲甘油等或专门的抗荧光淬灭的封片液。
有条件的话最好立即用荧光显微镜观察拍照,若不能及时拍照,也要做好封片和封固,保持避光和湿度。荧光显微镜的成像能力对最终的结果也会造成非常大的影响,好的荧光显微镜能够最大限度地收集荧光信号,并呈现高分辨率的图片,使细节更清楚,更易得到一张效果极佳的结果图。
切片清洗:为避免一抗、二抗等试剂残留而引起非特异性染色,所以适当地加强清洗(延长时间和增多次数)特别的重要,一般在一抗孵育前的清洗是3min*3次,而一抗孵育后的清洗均为5次*5min。
(4)PBS的PH和离子强度的使用和要求(建议PH在7.4-7.6,浓度是0.01M;中性及弱碱性条件有利于免疫复合物的形成,而酸性条件则有利于分解;低离子强度有利于免疫复合物的形成,而高离子强度则有利于分解)。
根据上述步骤完成免疫荧光实验后,就有必要进行荧光显微成像,得到我们想要的结果。选择一款简单易操作、成像清晰、效果卓越的荧光显微镜进行观察拍照,才能轻松得到更为理想的结果图,达到事半功倍的效果。

Echo Revolve正倒置一体荧光显微镜作为一款电动化、智能化的显微镜,具有以下优势:
极大地降低了背景噪音和荧光干扰,提高图像锐度,加深细节,得到分辨率更高的图片;
通过高精度电动化Z轴层扫来扩大景深,解决厚样本观察问题,提高图像分辨率;